Agencias
El director de la Administración de Alimentos y Medicamentos de Estados
Unidos (FDA por sus siglas en inglés) dijo el viernes que su agencia ha
proporcionado nuevas directrices a la Casa Blanca ante nueva información
según la cual una prueba rápida de COVID-19 utilizada por el presidente
Donald Trump y otras personas todos los días puede proporcionar
imprecisiones y resultados negativos falsos.
El comisionado Steve Hahn dijo que si se sospecha que una persona está
infectada con la enfermedad causada por el coronavirus, “valdría la
pena, si la prueba es negativa, obtener una segunda prueba
confirmatoria. De eso se tratan nuestras directrices”.
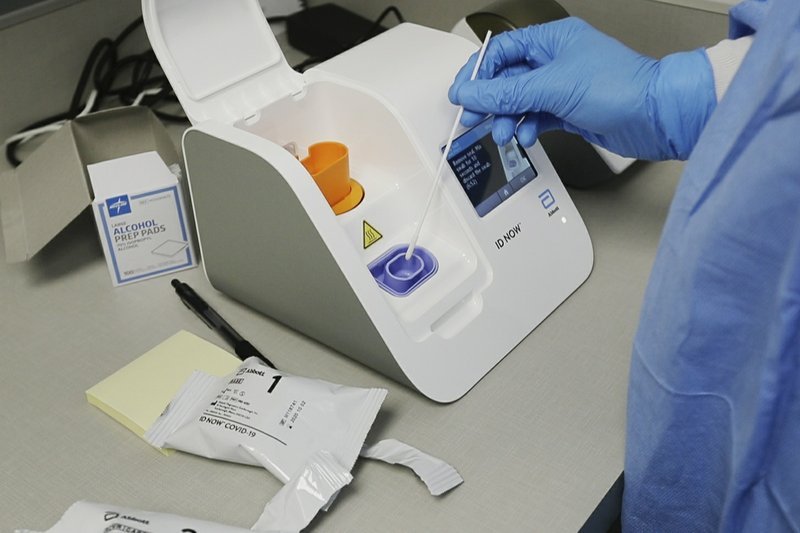
La prueba de Abbott Laboratories se utiliza todos los días en la Casa
Blanca para revisar a Trump y miembros cruciales de su personal,
incluido el grupo de trabajo de respuesta al coronavirus. La FDA dijo el
jueves por la noche que investigaba datos preliminares que daban a
entender que la prueba de 15 minutos puede pasar por alto casos de
COVID-19, al no detectar a personas infectadas.
Cuando le preguntaron el viernes en la cadena CBS si seguiría
recomendando el uso de la prueba en la Casa Blanca, Hahn respondió: “Esa
será una decisión de la Casa Blanca”. Pero señaló que la prueba está en
el mercado y la FDA sigue “recomendando su uso o la tiene disponible
para su uso”.
Las autoridades federales de salud han alertado a los médicos sobre la
posible imprecisión en la prueba, que se utiliza en miles de hospitales,
clínicas y sitios de pruebas a lo largo y ancho de Estados Unidos.
La advertencia de la FDA se produjo un día después de que los
investigadores de la Universidad de Nueva York reportaron que de acuerdo
con los resultados, la prueba de Abbott puede pasar por alto la mitad
de las infecciones detectadas por una prueba rival fabricada por
Cepheid. La investigación no ha sido revisada por expertos o publicada
en una revista médica y estaba basada en aproximadamente 100 pacientes.
Los investigadores encontraron que la prueba de Abbott, realizada en el
sistema de identificación portátil NOW de la compañía, omitió un tercio
de las infecciones que el test de Cepheid detectó cuando los hisopos se
almacenaron en líquido utilizado para transportar muestras de
laboratorio. Cuando las muestras se mantuvieron secas, la prueba no
detectó 48% de los casos revelados por Cepheid.
Los investigadores dijeron que el resultado de la prueba era
“inaceptable”, debido al riesgo de descartar erróneamente a enfermos que
podrían contagiar la infección a otras personas. Reconocieron las
deficiencias del estudio, incluido el tiempo necesario para transportar
las muestras de pacientes al dispositivo para su procesamiento.